デマの内容
次のような、妊婦に対する新型コロナワクチンの安全性を調べた論文(予備調査)の表を根拠として、

と主張する人がいますが、デマです。
デマの詳細
デマッターがデマの根拠としている論文がこちらです。
Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons
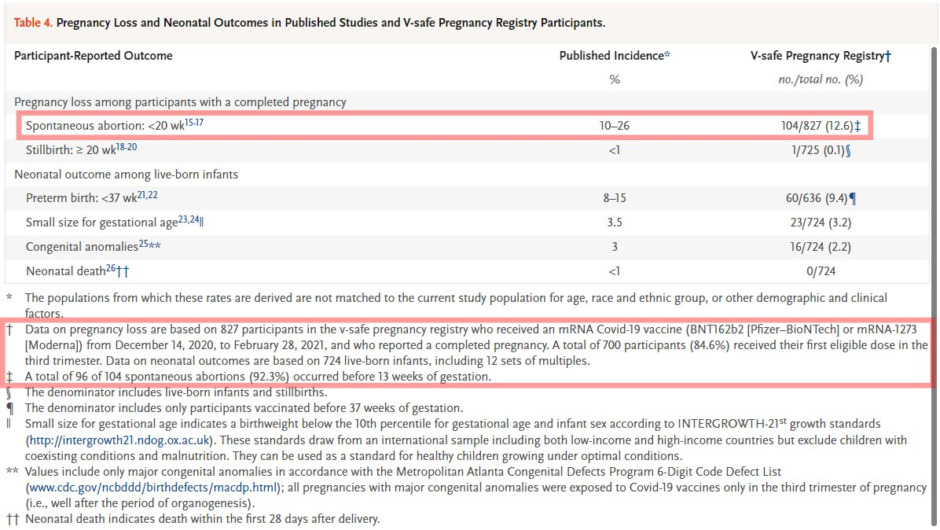
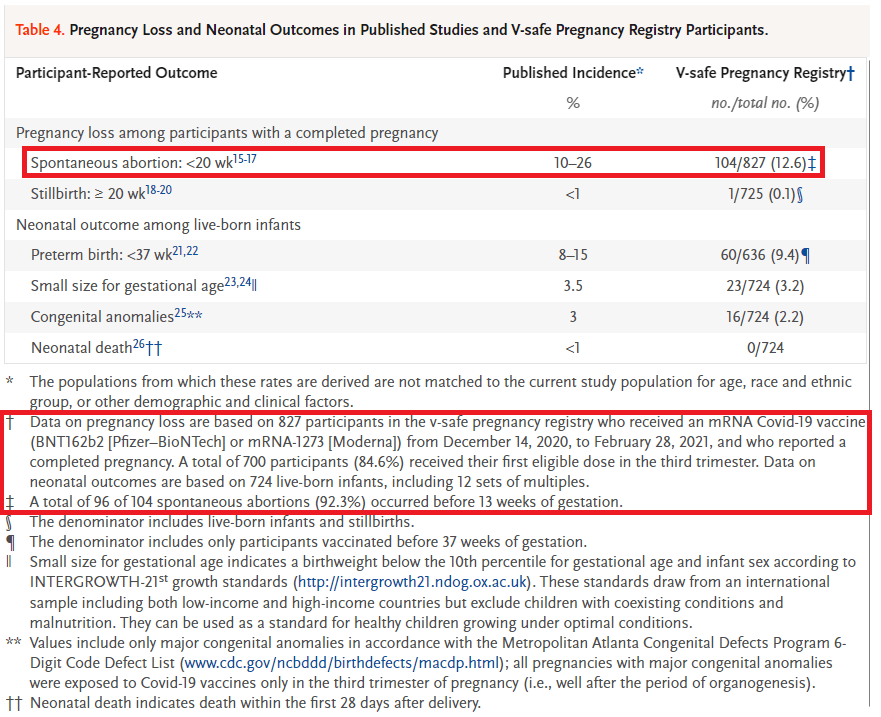
デマッターが「流産率は82%」の根拠として出してる論文中の表がこちらです。
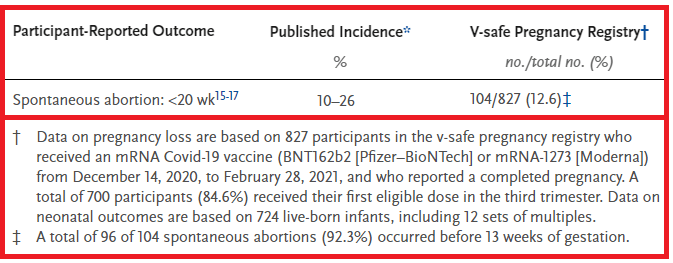
上記画像の中でデマッターが赤線で囲った部分をまとめるとこうなります。
日本語に翻訳するとこうなります。
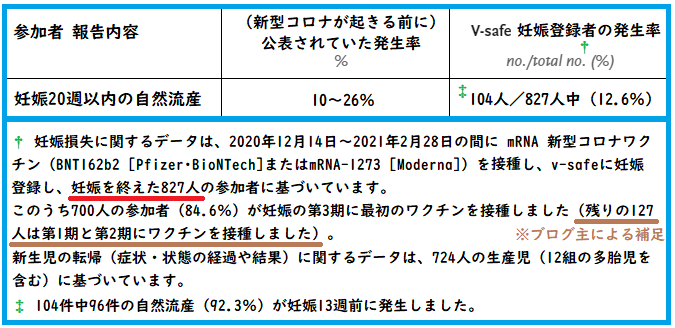
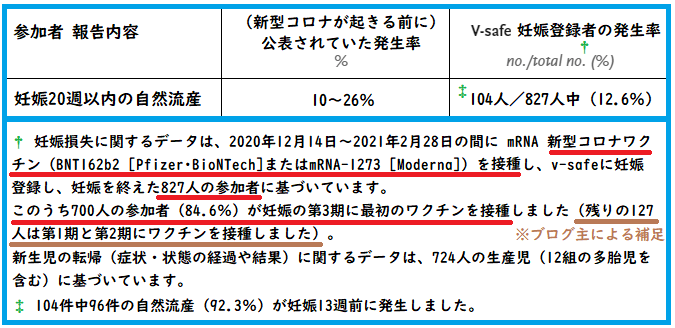
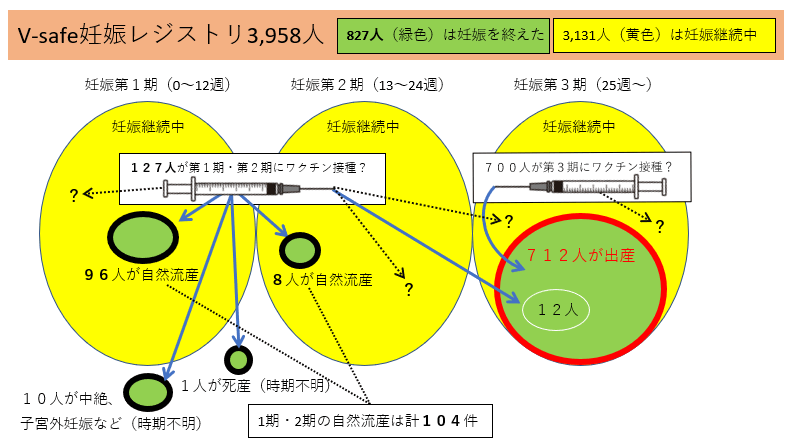
※図中の赤線にある通り、この表のデータは、妊娠登録者3,958人のうち、妊娠を終えた827人に関するデータです。
† Data on pregnancy loss are based on 827 participants in the v-safe pregnancy registry who received an mRNA Covid-19 vaccine (BNT162b2 [Pfizer–BioNTech] or mRNA-1273 [Moderna]) from December 14, 2020, to February 28, 2021, and who reported a completed pregnancy.
† 妊娠損失に関するデータは、2020年12月14日~2021年2月28日の間に mRNA 新型コロナワクチン(BNT162b2[ファイザー・ビオンテック]またはmRNA-1273[モデルナ])を接種し、v-safeに妊娠登録し、妊娠を終えた827人の参加者に基づいています。
A total of 700 participants (84.6%) received their first eligible dose in the third trimester.
このうち700人の参加者(84.6%)が妊娠の第3期に最初のワクチンを接種しました(※ブログ主の補足:残りの127人は第1期の直前~第2期にワクチンを接種しました)。
- 第1期…0~12週
- 第2期…13~24週
- 第3期…25週から分娩まで
Data on neonatal outcomes are based on 724 live-born infants, including 12 sets of multiples.
新生児の転帰(症状・状態の経過や結果)に関するデータは、724人の生産児(12組の多胎児を含む)に基づいています。
‡ A total of 96 of 104 spontaneous abortions (92.3%) occurred before 13 weeks of gestation.
‡ 104件中96件の自然流産(92.3%)が妊娠13週前に発生しました。
デマッターの主張を再掲します。

「127人」という数字がどこから出てきたかというと、下の画像の下段にある「新型コロナワクチン(中略)を接種し(中略)妊娠を終えた827人の参加者」「700人の参加者(84.6%)が妊娠の第3期に最初のワクチンを接種」というところですね。
「ワクチンを打った827人の参加者」から「妊娠の第3期にワクチンを接種した700人」を引くと、「妊娠20週目まで(妊娠の第1期の直前~第2期)に(ワクチンを)打った人は127人」となるわけです。
で、(妊娠20週目までに)「流産したのは104人」という数字はここから取ってますね。
- 妊娠20週目までにワクチンを打った人が127人
- 妊娠20週目までに流産した人が104人
だから

という主張です。
デマッターの計算が間違いである理由
論文中に数字がたくさん出てくるので、ちょっと分かりにくい(ややこしい)かもしれませんが、実際は単純な話です。
デマッターは、計算式の分母を間違えてます。
しつこいようですが、もう1度、デマッターの計算式を見てみましょう。

で、下の図を見てください。
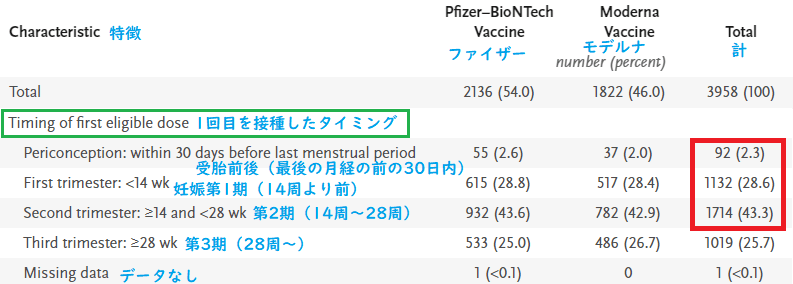
そもそも、調査対象の母数は3,958人なんです。デマッターの主張は、まるで、「妊娠を終えた827人」が調査対象の母数だったかのような言い方をしています。
第1期・第2期の自然流産104人(96+8)という数は、3,958人を調査したからこそ出てきた数字ですよ。827人を調査して自然流産104人が見つかったわけではなく、妊娠を終えた人(自然流産104人+死産1人+中絶など10人+出産712人)を合計したら827人になった、ということです。
より具体的に説明してみましょう。
104人の自然流産が起きた第1期・第2期において、ワクチンを接種したのは127人(デマッターの計算式の分母)だけでしょうか? いいえ。そのときに妊娠継続中だった人(上図の黄色い部分)が含まれていません。妊娠継続中だった人も含めると(受胎前後も含めて)第1期・第2期にワクチンを接種した人は、合計2,938人(92 + 1,132 + 1,714)になります。
論文中の「表3 V-safe妊娠レジストリの参加者の特徴」より
「ワクチンを接種した人の第1期・第2期における流産確率」を算出したいのであれば、第1期・第2期にワクチンを接種した総人数を分母にしなければなりません。そうですね?
- つまり、「ワクチンを接種した人の第1期・第2期における自然流産確率」は、この2,938人を分母として計算すれば、104/2,938≒3.5%になります。
- ついでに、「ワクチンを接種した人の第1期における自然流産確率」も出してみると、96/1,224(92 + 1,132)≒7.8%になります。
ただし、これは確定値ではありません。この論文は調査が完了していない段階で発表された「予備調査」であり、論文の発表時点において妊娠継続中の人がまだ3,131人もいて、その人達のデータを含めた完全なデータが揃うのは(この論文発表時の)まだ先のことです。そういう意味でも、この「予備調査」の論文を根拠として確定的なことを言うのは適切ではありません。
確定的なのは、デマッターの「自然流産率82%」という数字がデタラメだということですね。
参考
ファクトチェック記事
Debunked: No, 82% of women vaccinated against Covid-19 in the first third of pregnancy don’t miscarry
「妊娠初期に新型コロナワクチンを接種した女性の82%が流産したというのはデマ」
the research that was published in that journal does not say this
そのジャーナルに掲載された研究はそのようなことは(自然流産率82%などとは)述べていません。
What the research actually found was that just 12.6% of the women involved in the study whose pregnancies had ended by the time of publication had experienced a miscarriage.
調査から実際に判明したことは、調査の発表までに妊娠を終えていた妊婦の12.6%のみが流産を経験したということです。
The 82% figure is incorrect, because claimants have cherry-picked data that does not account for all pregnancies involved in the study.
82%という数字は正しくありません。なぜなら、調査に関わる他の妊娠が無視され、恣意的にデータがピックアップされているからです。
The remaining women – over 3,100 people – were still pregnant or had not followed-up with the study’s authors by the time the research was published.
研究の発表時点では、その他の女性(3,100人以上)はまだ妊娠中であるか、調査への回答をしていません。
Again, these 827 cases referred only to the number of women whose pregnancies were completed at the time the research was published.
繰り返しになりますが、この827人というのは、研究の発表前に妊娠を終えた女性のみを示しています。
There is nothing in the research that says women who were vaccinated in the first and second trimesters were more susceptible to miscarriages than those vaccinated in the third trimester.
研究では、第1期・第2期にワクチンを接種した女性が第3期に接種した女性よりも流産しやすいなどとは示されていません。
That does not mean they were the only women vaccinated at that stage:
同じ時期にワクチンを接種した女性が彼女たちだけとは限りません。
an additional 3,000 pregnancies – involving a large number of women who were vaccinated at the same time as those who miscarried – were not recorded as complete in the study.
他の3,000人の妊婦(流産した女性と同時期にワクチンを接種した多数の女性を含む)が、妊娠を終えたとは記録されていません。
We do not actually know the pregnancy outcomes of many women who were vaccinated in the first trimester, because they have not given birth yet.
妊娠第1期にワクチンを接種した女性の多くは、まだ妊娠を継続中であるため、その妊娠の結果は実際にはわかっていません。
So it is not reasonable to deduce the effects of vaccination on women who got an mRNA vaccine in early pregnancy based on 127 outcomes alone.
したがって、127(妊娠を終えた人のうち第1期・第2期にワクチン接種した人)の結果だけに基づいて、妊娠初期にmRNAワクチンを接種した女性におけるワクチンの効果を推測するのは正しくありません。
Doing this assumes that these 127 women were the only people involved in the study who were vaccinated in the first and second trimester, when this is not the case.
ワクチンを接種した127人を分母とするためには、妊娠第1期と第2期にワクチンを接種した女性がこの127人のみでなければいけませんが、実際はそうではありません。
Only 12.6% of women who had completed their pregnancies by the time the study was published had experienced a miscarriage – a proportion that is in line with usual rates.
研究の発表までに妊娠を終えた女性の12.6%だけが流産を経験しました。これは通常の割合と一致しています。
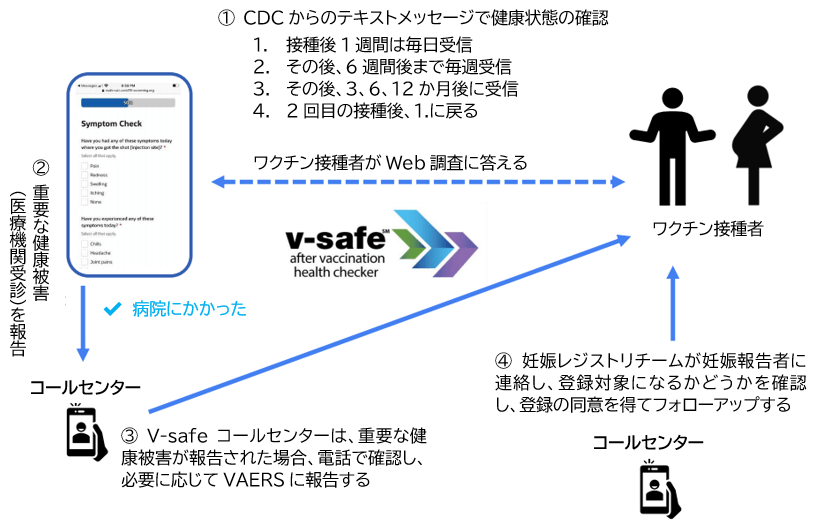
V-safeの仕組み
- 新型コロナワクチン接種後、スマホから登録
- テキストメッセージとWeb調査により接種後の有害事象を報告
- 重要な健康被害が報告された場合、電話で確認
- 妊娠の確認を行うことで、妊婦のフォローアップができる
https://www.cov19-vaccine.mhlw.go.jp/qa/pdf/0027_2.pdf
https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-02/28-03-01/05-covid-Shimabukuro.pdf
V-safe妊娠レジストリ3,958人が登録されたときの流れ
2020年12月14日~2021年2月28日の間に、V-safe登録者のうち、ワクチン接種済みで、妊娠していたのは35,691人。
そのうち、5,230人(ワクチン接種時に妊娠していたか、ワクチン接種のすぐ後でV-safe調査中に妊娠した人)に連絡
- ワクチン接種のかなり前に妊娠していた人は除外
- ワクチン接種のかなり後に妊娠していた人は除外
V-safe妊娠レジストリの登録基準をクリアしてV-safe妊娠レジストリに登録されたのは3,958人(妊娠中または受胎前後の機関にワクチンを接種した人)。
「有害事象」について
V-SafeやVAERSに関する話題では、「有害事象(adverse event)」という言葉がよく出てきますが、これはワクチンとの因果関係が認められたもの(原因)ではないという点に注意してください。
ワクチンの本当の害を(もしあった場合は)見逃さないようにするため、ワクチン接種後に起きた一見無関係と思われるような有害な事象も報告されています(たとえば交通事故や落雷による被害なども報告対象となり得る)。
参考記事:有害事象報告システムのデータを出して “ワクチンは危険だ” と主張するのは不適切
論文の(ほぼ)全訳
Google翻訳をベースにしてブログ主が修正を入れた、論文の日本語訳です。
Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons
妊婦に対するmRNA新型コロナワクチンの安全性に関する予備的調査
Abstract
概要
BACKGROUND
バックグラウンド
Many pregnant persons in the United States are receiving messenger RNA (mRNA) coronavirus disease 2019 (Covid-19) vaccines, but data are limited on their safety in pregnancy.
米国の多くの妊婦がmRNA新型コロナワクチンを接種していますが、妊娠中における安全性のデータは(まだ)限られています。
METHODS
メソッド
From December 14, 2020, to February 28, 2021, we used data from the“v-safe after vaccination health checker”surveillance system, the v-safe pregnancy registry, and the Vaccine Adverse Event Reporting System (VAERS) to characterize the initial safety of mRNA Covid-19 vaccines in pregnant persons.
2020年12月14日から2021年2月28日まで、V-safe ワクチン接種後ヘルスチェッカー監視システム、V-safe妊娠レジストリ、およびワクチン有害事象報告システム(VAERS)のデータを使用して、妊婦におけるmRNA新型コロナワクチンの初期の安全性を明らかにしました。
RESULTS
結果
A total of 35,691 v-safe participants 16 to 54 years of age identified as pregnant.
V-safe参加者の合計35,691人(16〜54歳)が妊娠していると特定された。
Injection-site pain was reported more frequently among pregnant persons than among nonpregnant women, whereas headache, myalgia, chills, and fever were reported less frequently.
注射部位の痛みは、妊娠していない女性よりも妊娠している人の間でより頻繁に報告されたが、頭痛、筋肉痛、悪寒、および発熱の報告はむしろ少なかった。
Among 3958 participants enrolled in the v-safe pregnancy registry, 827 had a completed pregnancy, of which 115 (13.9%) resulted in a pregnancy loss and 712 (86.1%) resulted in a live birth (mostly among participants with vaccination in the third trimester).
V-safe妊娠レジストリに登録された3,958人の参加者のうち、827人が妊娠を終えた。そのうち115人(13.9%)が流産になり、712人(86.1%)が出産した(ほとんどは第3期にワクチンを接種した参加者)。
Adverse neonatal outcomes included preterm birth (in 9.4%) and small size for gestational age (in 3.2%); no neonatal deaths were reported.
新生児の有害な転帰には、早産(9.4%)と在胎不当過小(3.2%)が含まれていましたが、新生児死亡は報告されていません。
Although not directly comparable, calculated proportions of adverse pregnancy and neonatal outcomes in persons vaccinated against Covid-19 who had a completed pregnancy were similar to incidences reported in studies involving pregnant women that were conducted before the Covid-19 pandemic.
直接比較することはできませんが、新型コロナワクチンを接種して妊娠を終えた人の有害な妊娠と新生児転帰の割合は、新型コロナのパンデミックの前に実施された、妊婦を調査対象とした研究報告での発生率と同様でした。
Among 221 pregnancy-related adverse events reported to the VAERS, the most frequently reported event was spontaneous abortion (46 cases).
VAERSに報告された221の妊娠関連の有害事象の中で、最も頻繁に報告された事象は自然流産でした(46例)。
CONCLUSIONS
結論
Preliminary findings did not show obvious safety signals among pregnant persons who received mRNA Covid-19 vaccines.
予備調査の結果では、新型コロナワクチンを接種した妊婦の間で明らかな安全性の懸念は示されませんでした。
However, more longitudinal follow-up, including follow-up of large numbers of women vaccinated earlier in pregnancy, is necessary to inform maternal, pregnancy, and infant outcomes.
ただし、母親、妊娠、および乳児の転帰についての情報を提供するために、より長期的なフォローアップ(妊娠初期にワクチン接種を受けた多数の女性のフォローアップを含む)が必要です。
The first coronavirus disease 2019 (Covid-19) vaccines available in the United States were messenger RNA (mRNA) vaccines: BNT162b2 (Pfizer–BioNTech) and mRNA-1273 (Moderna).
米国で最初に利用可能になった新型コロナ(Covid-19)用のワクチンはメッセンジャーRNA(mRNA)ワクチン(BNT162b2[ファイザー・ビオンテック]およびmRNA-1273[モデルナ])でした。
In December 2020, the vaccines were granted Emergency Use Authorization (EUA) by the Food and Drug Administration (FDA) as a two-dose series, 3 weeks apart for Pfizer–BioNTech and 1 month apart for Moderna, and were recommended for use by the Advisory Committee on Immunization Practices (ACIP).
2020年12月、ワクチンはFDA(食品医薬品局)から2回の接種を1セットとして緊急使用許可(EUA)が与えられました。使用間隔は、ACIP(予防接種の実施に関する諮問委員会)の推奨では、ファイザー・ビオンテックは3週間、モデルナは1か月です。
Pregnant persons were excluded from preauthorization clinical trials, and only limited human data on safety during pregnancy were available at the time of authorization.
妊婦は事前承認の臨床試験から除外されていたため、ワクチン承認時に妊婦の安全性に関するデータは限られていました。
However, pregnant persons with Covid-19 are at increased risk for severe illness (e.g., resulting in admission to an intensive care unit, extracorporeal membrane oxygenation, or mechanical ventilation) and death, as compared with nonpregnant persons of reproductive age.
ただし、妊娠中に新型コロナに感染すると、妊娠していない人(受胎能力がある人)と比較して、重度の病気(集中治療室での治療、ECMO[体外式膜型人工肺]、または人工呼吸器など)および死亡のリスクが高くなります。
Furthermore, pregnant persons with Covid-19 might be at increased risk for adverse pregnancy outcomes, such as preterm birth, as compared with pregnant persons without Covid-19.
さらに、妊娠中に新型コロナに感染した人は、感染していない妊婦と比較して、早産などの有害な妊娠転帰のリスクが高くなる可能性があります。
The Centers for Disease Control and Prevention (CDC) and ACIP, in collaboration with the American College of Obstetricians and Gynecologists and the American Academy of Pediatrics, have issued guidance indicating that Covid-19 vaccines should not be withheld from pregnant persons.
CDC(米国疾病予防管理センター)とACIP(予防接種の実施に関する諮問委員会)は、米国産科婦人科学会および米国小児科学会と協力して、妊婦が新型コロナワクチンの接種を控えるべきではないとするガイダンスを発行しました。
Postauthorization monitoring in pregnant persons is necessary to characterize the safety of these new Covid-19 vaccines, which use mRNA, lipid nanoparticles, and state-of-the-art manufacturing processes.
ワクチン承認後の妊婦のモニタリングは、mRNA/脂質ナノ粒子/最先端の製造プロセスを採用している新型コロナワクチンについて、その安全性を明らかにするために必要です。
Furthermore, establishing their safety profiles is critical to inform recommendations on maternal vaccination against Covid-19.
さらに、安全性についてのデータを確立することは、妊婦に新型コロナワクチンの接種を促すためにも重要なことです。
We report preliminary findings of mRNA Covid-19 vaccine safety in pregnant persons from three U.S. vaccine safety monitoring systems: the “v-safe after vaccination health checker” surveillance system, the v-safe pregnancy registry, and the Vaccine Adverse Event Reporting System (VAERS).
米国の3つのワクチン安全性監視システム(V-safeワクチン接種後ヘルスチェッカー監視システム、V-safe妊娠レジストリおよびワクチン有害事象報告システム(VAERS))を使用して、妊婦に対するmRNA新型コロナワクチンの安全性に関して、予備調査の結果を報告します。
Methods
メソッド
MONITORING SYSTEMS AND COVERED POPULATIONS
監視システムと対象集団
V-safe Surveillance System and Pregnancy Registry
V-safe監視システムとV-safe妊娠レジストリ
V-safe is a new CDC smartphone-based active-surveillance system developed for the Covid-19 vaccination program; enrollment is voluntary.
V-safeは、新型コロナワクチン接種プログラム用に開発されたCDCの新しいスマートフォンベースのアクティブ監視システムで、登録は任意です。
V-safe sends text messages to participants with weblinks to online surveys that assess for adverse reactions and health status during a postvaccination follow-up period.
V-safeは、調査用のページのWebリンクを含むテキストメッセージを参加者に送信します。この調査により、ワクチン接種後のフォローアップ期間中の副作用と健康状態が評価されます。
Follow-up continues 12 months after the final dose of a Covid-19 vaccine.
フォローアップは、新型コロナワクチンの最後の接種後12か月間継続されます。
During the first week after vaccination with any dose of a Covid-19 vaccine, participants are prompted to report local and systemic signs and symptoms during daily surveys and rank them as mild, moderate, or severe;
新型コロナワクチン接種後(1度目、2度目のいずれも)の最初の週に、参加者は、毎日、局所的および全身的な徴候と症状を軽度・中度・重度にランク付けして報告するように促されます。
surveys at all time points assess for events of adverse health effects.
調査では、すべての時点において、健康に悪影響を及ぼす事象を評価します。
If participants indicate that they required medical care at any time point, they are asked to complete a report to the VAERS through active telephone outreach.
参加者に医療のケアが必要だったと判断された場合は、電話による確認が積極的に行われ、VAERSに報告するよう求められます。
To identify persons who received one or both Covid-19 vaccine doses while pregnant or who became pregnant after Covid-19 vaccination, v-safe surveys include pregnancy questions for persons who do not report their sex as male.
妊娠中に1回または2回の新型コロナワクチンを接種した人、または新型コロナワクチン接種後に妊娠した人を特定するために、V-safe調査には、性別を男性として報告していない人に対する妊娠の質問が含まれます。
Persons who identify as pregnant are then contacted by telephone and, if they meet inclusion criteria, are offered enrollment in the v-safe pregnancy registry.
妊娠しているとされる人には電話による連絡が行われ、選択基準を満たしている場合は、V-safe妊娠レジストリへの登録が促されます。
Eligible persons are those who received vaccination during pregnancy or in the periconception period (30 days before the last menstrual period through 14 days after) and are 18 years of age or older.
V-safe妊娠レジストリへの登録対象となるのは、18歳以上で、妊娠中にワクチンを接種した人か、受胎前後の期間(最後の月経の30日前から14日後まで)にワクチンを接種した人です。
For persons who choose to enroll, the pregnancy registry telephone-based survey collects detailed information about the participant, including medical and obstetric history, pregnancy complications, birth outcomes, and contact information for obstetric and pediatric health care providers to obtain medical records;
V-safe妊娠レジストリに登録した人からは、電話ベースの調査により、詳細な情報が収集されます。これには、病歴および産科既往歴、妊娠の合併症、出産の転帰、医療記録の取得に必要な産科および小児科の連絡先が含まれます。
infants are followed through the first 3 months of life.
乳児は生後3ヶ月間追跡されます。
Details about v-safe and v-safe pregnancy registry methods have been published previously.
V-safeおよびV-safe妊娠レジストリのメソッドの詳細は以前に公開されています。
VAERS
VAERS
The VAERS is a national spontaneous-reporting (passive-surveillance) system established in 1990 that is administered by the CDC and the FDA.
VAERSは、1990年に設立された全国的な自発的報告(受動的監視)システムであり、CDCとFDAによって管理されています。
Anyone can submit a report to the VAERS.
誰でもVAERSに報告を提出できます。
Health care providers are required to report certain adverse events after vaccination, including pregnancy-related complications resulting in hospitalization and congenital anomalies, under the conditions of the EUAs for Covid-19 vaccines;
医療提供者は、新型コロナワクチンの緊急使用許可(EUA)の条件の下、ワクチン接種後の特定の有害事象(入院や先天性異常をもたらす妊娠関連の合併症を含む)を報告する必要があります。
the CDC encourages reporting of any clinically significant maternal and infant adverse events.
CDCは、臨床的に重要な、母体および乳児の有害事象の報告を奨励しています。
Signs and symptoms of adverse events are coded with the use of the Medical Dictionary for Regulatory Activities (MedDRA), version 23.1.
有害事象の兆候と症状は、「医薬品規制用語集(MedDRA)」バージョン23.1を使用して記載されています。
We used a pregnancy-status question in the VAERS form and a MedDRA code and text-string search to identify reports involving vaccination in pregnant persons.
我々は、VAERSの妊娠状況に関する質問フォーム/MedDRAの規定/テキスト検索を使用して、ワクチンを接種した妊婦に関する報告を特定しました。
OUTCOMES
結果
V-safe outcomes included participant-reported local and systemic reactogenicity to the BNT162b2 (Pfizer–BioNTech) vaccine and the mRNA-1273 (Moderna) vaccine on the day after vaccination among all pregnant persons 16 to 54 years of age and among nonpregnant women 16 to 54 years of age as a comparator.
V-safeの結果には、参加者が報告したワクチンの局所的および全身的な副反応が含まれていました。これらの副反応は、BNT162b2(ファイザー・ビオンテック)ワクチンまたはmRNA-1273(モデルナ)ワクチンを接種した翌日にあらわれたものです。調査の対象者は、16~54歳の妊娠中の女性と、(比較として)16~54歳の妊娠していない女性でした。
For analysis of pregnancy outcomes in the v-safe pregnancy registry, data were restricted to completed pregnancies (i.e., live-born infant, spontaneous abortion, induced abortion, or stillbirth).
V-safe妊娠レジストリでによる妊娠結果の分析は、妊娠を終えた人(すなわち、生児、自然流産、誘発流産、または死産)にデータが限定されました。
Participant-reported pregnancy outcomes included pregnancy loss (spontaneous abortion and stillbirth) and neonatal outcomes (preterm birth, congenital anomalies, small size for gestational age, and neonatal death) (Table S1 in the Supplementary Appendix, available with the full text of this article at NEJM.org).
参加者から報告された妊娠の転帰には、流産(自然流産と死産)および新生児の転帰(早産、先天性異常、在胎不当過小、および新生児死亡)が含まれていました(補足付録の表S1。この記事の全文とともにNEJM.orgで入手可能)。
In the VAERS, outcomes included non–pregnancy-specific adverse events and pregnancy- and neonatal-specific adverse events.
VAERSで報告された有害事象には、妊娠に固有ではない有害事象と、妊娠および新生児に固有の有害事象が含まれていました。
STATISTICAL ANALYSIS
統計分析
Demographic information and pregnancy characteristics are described for both v-safe and VAERS participants.
V-safeとVAERSの両方の参加者について、人口統計情報と妊娠の特徴が説明されています。
Descriptive analyses were performed with the use of v-safe survey data for persons who identified as pregnant through February 28, 2021 (35,691 persons);
記述的分析は、2021年2月28日までに妊娠していると特定された人(35,691人)のV-safe調査データを使用して行われました。
persons enrolled in the v-safe pregnancy registry who were vaccinated through February 28, 2021 (3958 persons);
2021年2月28日までに予防接種を受けてV-safe妊娠レジストリに登録されたのは3,958人です。
and VAERS reports involving pregnant women received through February 28, 2021 (221 persons).
また、2021年2月28日までに報告された妊婦に関するVAERSレポート(221人)が使用されました。
Local and systemic reactogenicity was compared between persons who identified as pregnant and nonpregnant women.
妊娠中および非妊娠中の女性と特定された人の間で、局所的および全身的な副反応を比較しました。
Descriptive analyses were conducted with the use of SAS software, version 9.4 (SAS Institute).
記述的分析は、SASソフトウェアバージョン9.4(SAS Institute)を使用して実施されました。
All activities were reviewed by the CDC and were conducted in accordance with applicable federal law and CDC policy.
すべての活動はCDCによってレビューされ、適用される連邦法およびCDCポリシーに従って実施されました。
Results
結果
V-SAFE SURVEILLANCE: LOCAL AND SYSTEMIC REACTOGENICITY IN PREGNANT PERSONS
V-safe による観察:妊娠中の人の局所的および全身的な副反応
From December 14, 2020, to February 28, 2021, a total of 35,691 v-safe participants identified as pregnant.
2020年12月14日から2021年2月28日の間に、合計35,691人のV-safe参加者が妊娠していると特定されました。
Age distributions were similar among the participants who received the Pfizer–BioNTech vaccine and those who received the Moderna vaccine, with the majority of the participants being 25 to 34 years of age (61.9% and 60.6% for each vaccine, respectively) and non-Hispanic White (76.2% and 75.4%, respectively);
年齢分布は、ファイザーのワクチンを接種した参加者とモデルナのワクチンを接種した参加者の間で類似しており、参加者の大多数は25~34歳(各ワクチンでそれぞれ61.9%と60.6%)、非ヒスパニック系の白人(それぞれ76.2%と75.4%)でした。
most participants (85.8% and 87.4%, respectively) reported being pregnant at the time of vaccination (Table 1).
ほとんどの参加者(それぞれ85.8%と87.4%)は、ワクチン接種時に妊娠していたと報告されています(表1)。
Table 1. Characteristics of Persons Who Identified as Pregnant in the V-safe Surveillance System and Received an mRNA Covid-19 Vaccine
表1 V-safe監視システムで妊娠していると特定され、mRNA新型コロナワクチンを接種した人の特徴
* Shown are the characteristics of v-safe participants 16 to 54 years of age who identified as pregnant and who received a messenger RNA (mRNA) coronavirus disease 2019 (Covid-19) vaccine — BNT162b2 (Pfizer–BioNTech) or mRNA-1273 (Moderna) — from December 14, 2020, to February 28, 2021. Percentages may not total 100 because of rounding.
* 2020年12月14日~2021年2月28日までに、妊婦と特定され、mRNA新型コロナワクチン( BNT162b2[ファイザー・ビオンテック]またはmRNA-1273[モデルナ])を接種した、V-safe参加者(16~54歳)の特徴 。四捨五入により、パーセンテージの合計が100にならない場合があります。
† Race and ethnic group were reported by the participants. Questions about race and ethnic group were added to v-safe after launch of the platform; not all pregnancies had recorded race and ethnic group at the time of data analysis. Therefore, data on race and ethnic group were missing for 22.8% of the total number of participants who identified as pregnant (4932 participants receiving the Pfizer–BioNTech vaccine and 3207 receiving the Moderna vaccine).
† 参加者から人種や民族が報告されました。プラットフォームの立ち上げ後、人種や民族に関する質問がV-safeに追加されました。データ分析の時点で、すべての妊婦の人種および民族が報告されているわけではありません。妊娠していると特定された参加者の22.8%は人種および民族に関するデータが欠落していました(4,932人の参加者がファイザー・ビオンテックのワクチン、3,207人の参加者がモデルナのワクチンでした)。
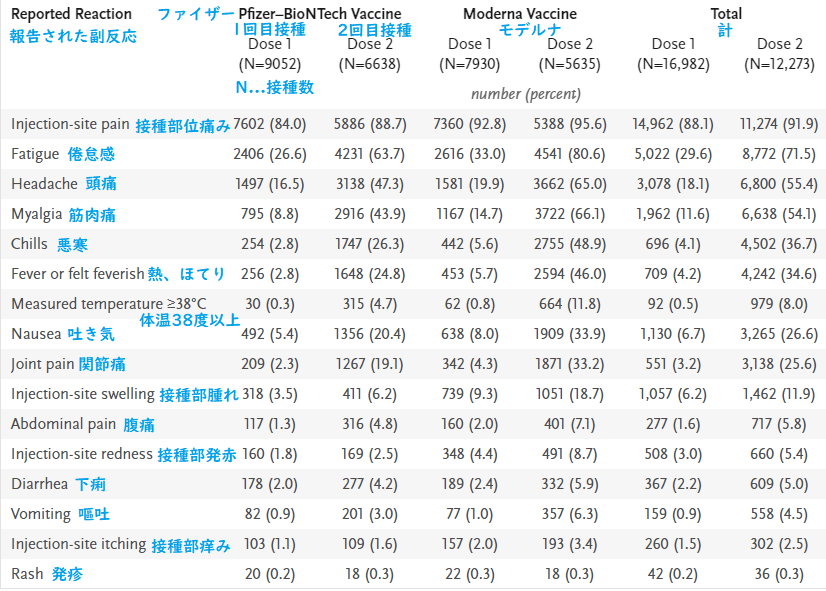
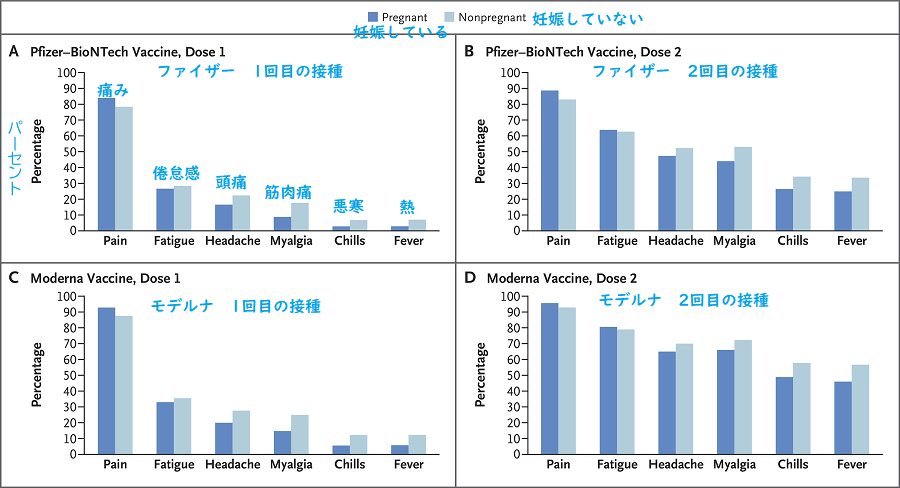
Solicited reports of injection-site pain, fatigue, headache, and myalgia were the most frequent local and systemic reactions after either dose for both vaccines (Table 2) and were reported more frequently after dose 2 for both vaccines.
参加者からの報告によると、両方のワクチンで最も多い局所および全身反応は、注射部位の痛み、倦怠感、頭痛、および筋肉痛でした(表2)。そして、いずれのワクチンの場合でも、2回目の接種後により多く報告されました。
Table 2. Frequency of Local and Systemic Reactions Reported on the Day after mRNA Covid-19 Vaccination in Pregnant Persons.
表2 妊娠中の人がmRNA新型コロナワクチン接種の翌日に報告した局所および全身反応の頻度
Shown are solicited reactions in v-safe participants 16 to 54 years of age who identified as pregnant and who received an mRNA Covid-19 vaccine (BNT162b2 [Pfizer–BioNTech] or mRNA-1273 [Moderna]) from December 14, 2020, to February 28, 2021.
* 2020年12月14日~2021年2月28日に、妊婦と特定され新型コロナワクチン(BNT162b2[ファイザー・ビオンテック]またはmRNA-1273[モデルナ])を接種した16〜54歳のV-safe参加者の副反応
Participant-measured temperature at or above 38°C was reported by less than 1% of the participants on day 1 after dose 1 and by 8.0% after dose 2 for both vaccines.
両方のワクチンで、接種の翌日に体温が38°C以上(参加者自身による測定)になった参加者の割合は、1回目の接種後は1%未満、2回目の接種後は8.0%でした。
These patterns of reporting, with respect to both most frequently reported solicited reactions and the higher reporting of reactogenicity after dose 2, were similar to patterns observed among nonpregnant women (Figure 1).
これらの報告されたパターン(最も多かった副反応および2回目接種後に(1回目よりも)より多く報告された副反応)は、妊娠していない女性で観察されたパターンと類似していました(図1)。
Figure 1. Most Frequent Local and Systemic Reactions Reported in the V-safe Surveillance System on the Day after mRNA Covid-19 Vaccination.
図1 mRNA新型コロナワクチン接種の翌日にV-safe監視システムに報告された最も多い局所および全身の反応
Shown are solicited reactions in pregnant persons and nonpregnant women 16 to 54 years of age who received a messenger RNA (mRNA) coronavirus disease 2019 (Covid-19) vaccine — BNT162b2 (Pfizer–BioNTech) or mRNA-1273 (Moderna) — from December 14, 2020, to February 28, 2021. The percentage of respondents was calculated among those who completed a day 1 survey, with the top events shown of injection-site pain (pain), fatigue or tiredness (fatigue), headache, muscle or body aches (myalgia), chills, and fever or felt feverish (fever).
2020年12月14日~2021年2月28日に、mRNA新型コロナワクチン(BNT162b2[ファイザー・ビオンテック]またはmRNA-1273[モデルナ])を接種した、妊娠している人と妊娠してない人(16〜54歳)の副反応。回答者の割合は、1日目の調査の回答から作成されました。最も多かったのは注射部位の痛み(Pain)、続いて疲労または倦怠感(Fatigue)、頭痛(Headache)、筋肉または体の痛み(Myalgia)、寒気(Chills)、発熱またはほてり(Fever)でした。
Small differences in reporting frequency between pregnant persons and nonpregnant women were observed for specific reactions (injection-site pain was reported more frequently among pregnant persons, and other systemic reactions were reported more frequently among nonpregnant women), but the overall reactogenicity profile was similar.
妊娠中の人と妊娠していない女性の間において、特定の副反応の報告頻度にわずかな違いがありました(注射部位の痛みは妊娠中の人の間でより頻繁に報告され、他の全身反応は妊娠していない女性の間でより頻繁に報告されました)が、副反応の全体的なデータは類似していました。
Pregnant persons did not report having severe reactions more frequently than nonpregnant women, except for nausea and vomiting, which were reported slightly more frequently only after dose 2 (Table S3).
妊娠していない女性と比較して、2回目接種後の悪心と嘔吐が妊娠中の人からわずかに多く報告されましたが、重篤な副反応の報告数が多いということはありませんでした(表S3)。
V-SAFE PREGNANCY REGISTRY: PREGNANCY OUTCOMES AND NEONATAL OUTCOMES
V-safe 妊娠レジストリ:妊娠転帰と新生児転帰
As of March 30, 2021, the v-safe pregnancy registry call center attempted to contact 5230 persons who were vaccinated through February 28, 2021, and who identified during a v-safe survey as pregnant at or shortly after Covid-19 vaccination.
2021年3月30日の時点で、V-safe妊娠レジストリのコールセンターは、2021年2月28日までにワクチン接種を受けていた5,230人(ワクチン接種時に妊娠していたか、ワクチン接種のすぐ後でV-safe調査中に妊娠した人)に連絡を試みました。
Of these, 912 were unreachable, 86 declined to participate, and 274 did not meet inclusion criteria (e.g., were never pregnant, were pregnant but received vaccination more than 30 days before the last menstrual period, or did not provide enough information to determine eligibility).
これらのうち、912人とは連絡がつかず、86人はV-safe妊娠レジストリへの参加を拒否し、274人は登録基準を満たしていませんでした(たとえば、妊娠ではなかった/妊娠していたがワクチン接種を受けたのが最後の月経の30日以上前だった/登録基準を判定するための十分な情報を提供しなかった等)。
The registry enrolled 3958 participants with vaccination from December 14, 2020, to February 28, 2021, of whom 3719 (94.0%) identified as health care personnel.
2020年12月14日から2021年2月28日までの間にワクチンを接種した3,958人がV-safe妊娠レジストリに登録されました(そのうち3,719人[94.0%]が医療従事者でした)。
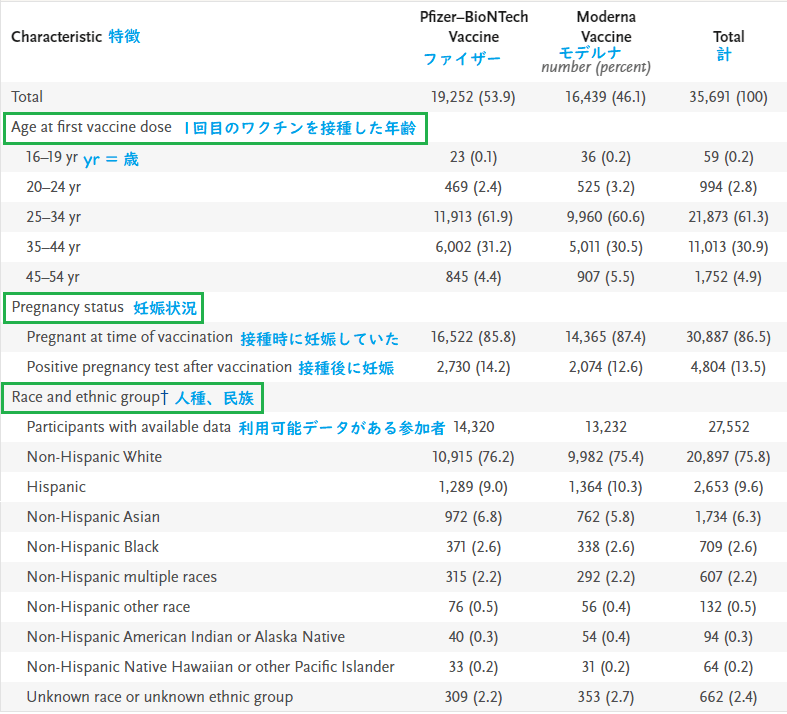
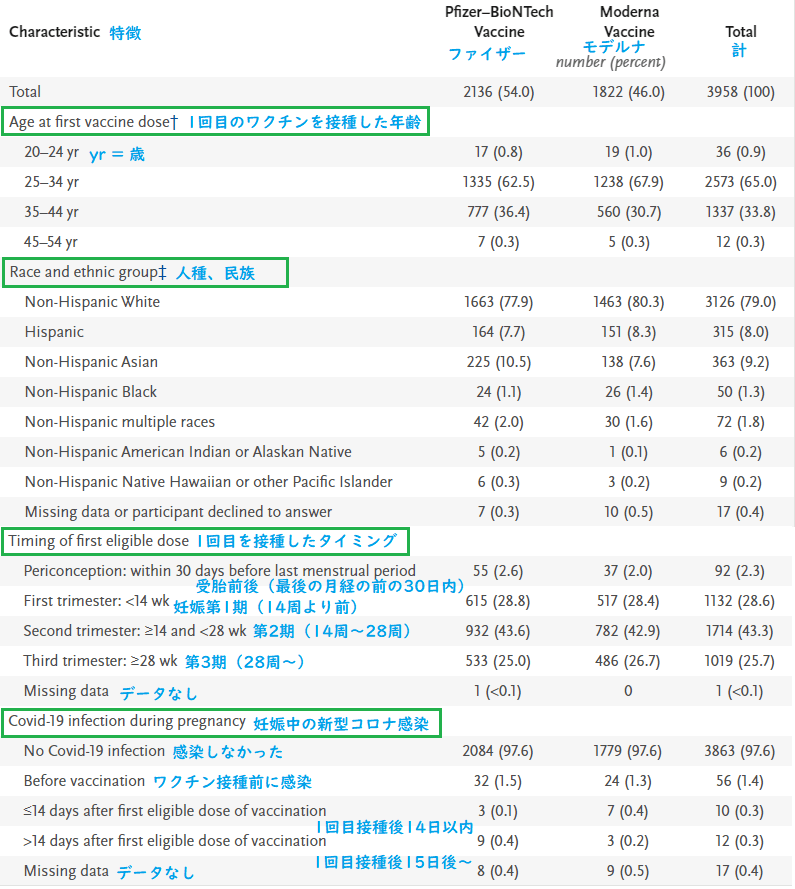
Among enrolled participants, most were 25 to 44 years of age (98.8%), non-Hispanic White (79.0%), and, at the time of interview, did not report a Covid-19 diagnosis during pregnancy (97.6%) (Table 3).
登録された参加者のほとんどは25~44歳(98.8%)の非ヒスパニック系白人(79.0%)であり、聞き取り調査の時点では、ほとんどは妊娠中に新型コロナに感染しませんでした(97.6%)(表3)。
Table 3. Characteristics of V-safe Pregnancy Registry Participants.
表3 V-safe妊娠レジストリの参加者の特徴
Shown are registry participants who received an mRNA Covid-19 vaccine (BNT162b2 [Pfizer–BioNTech] or mRNA-1273 [Moderna]) from December 14, 2020, to February 28, 2021. Percentages may not total 100 because of rounding.
2020年12月14日~2021年2月28日に、mRNA新型コロナワクチン(BNT162b2[ファイザー・ビオンテック]またはmRNA-1273[モデルナ])を接種したV-safe妊娠レジストリの参加者。四捨五入により、パーセンテージの合計が100にならない場合があります。
The v-safe pregnancy registry is only enrolling pregnant persons 18 years of age or older; at the time of this analysis, no participants were younger than 20 years of age.
V-safe妊娠レジストリは、18歳以上の妊娠者のみを登録しています。この分析の時点では、20歳未満の参加者はいませんでした。
Race and ethnic group were reported by the participants.
参加者から人種や民族が報告されました。
Receipt of a first dose of vaccine meeting registry-eligibility criteria was reported by 92 participants (2.3%) during the periconception period, by 1132 (28.6%) in the first trimester of pregnancy, by 1714 (43.3%) in the second trimester, and by 1019 (25.7%) in the third trimester (1 participant was missing information to determine the timing of vaccination) (Table 3).
V-safe妊娠レジストリの登録基準を満たす1回目のワクチンが接種されたタイミングは、受胎前後の期間が92人(2.3%)、妊娠の第1期が1,132人(28.6%)、第2期が1,714(43.3%)、そして第3期が1,019人(25.7%)でした(1人はワクチン接種のタイミングが不明)(表3)。
Among 1040 participants (91.9%) who received a vaccine in the first trimester and 1700 (99.2%) who received a vaccine in the second trimester, initial data had been collected and follow-up scheduled at designated time points approximately 10 to 12 weeks apart;
第1期にワクチンを接種した(1,132人のうち)1,040人(91.9%)と第2期にワクチンを接種した(1,714人のうち)1,700人(99.2%)の中から初期データが収集され、約10~12週間の間隔を置いて特定の時点でのフォローアップがスケジュールされました。
limited follow-up calls had been made at the time of this analysis.
この分析の時点では、電話による限定的なフォローアップが行われていました。
Among 827 participants who had a completed pregnancy, the pregnancy resulted in a live birth in 712 (86.1%), in a spontaneous abortion in 104 (12.6%), in stillbirth in 1 (0.1%), and in other outcomes (induced abortion and ectopic pregnancy) in 10 (1.2%).
妊娠を終えた827人のうち、出産が712人(86.1%)、自然流産が104人(12.6%)、死産が1人(0.1%)、その他が10人(中絶、子宮外妊娠など1.2%)でした。
A total of 96 of 104 spontaneous abortions (92.3%) occurred before 13 weeks of gestation (Table 4), and 700 of 712 pregnancies that resulted in a live birth (98.3%) were among persons who received their first eligible vaccine dose in the third trimester.
104人の自然流産のうち96件(92.3%)が妊娠13週目より前に起きました(表4)。出産した712人のうち700人(98.3%)は、第3期に最初のワクチンを接種していました。
Table 4. Pregnancy Loss and Neonatal Outcomes in Published Studies and V-safe Pregnancy Registry Participants.
表4 流産・新生児転帰に関する過去の調査データとV-safe妊娠レジストリのデータの比較
The populations from which these rates are derived are not matched to the current study population for age, race and ethnic group, or other demographic and clinical factors.
* これら(過去の調査データ)の率が導き出された集団は、年齢/人種/民族/その他の人口統計学的および臨床的要因において、現在の調査対象の集団と一致していません。
Data on pregnancy loss are based on 827 participants in the v-safe pregnancy registry who received an mRNA Covid-19 vaccine (BNT162b2 [Pfizer–BioNTech] or mRNA-1273 [Moderna]) from December 14, 2020, to February 28, 2021, and who reported a completed pregnancy. A total of 700 participants (84.6%) received their first eligible dose in the third trimester. Data on neonatal outcomes are based on 724 live-born infants, including 12 sets of multiples.
† 妊娠損失に関するデータは、2020年12月14日~2021年2月28日の間に mRNA 新型コロナワクチン(BNT162b2[ファイザー・ビオンテック]またはmRNA-1273[モデルナ])を接種し、V-safeに妊娠登録し、妊娠を終えた827人の参加者に基づいています。このうち700人の参加者(84.6%)が妊娠の第3期に最初のワクチンを接種しました。新生児の転帰(症状・状態の経過や結果)に関するデータは、724人の生産児(12組の多胎児を含む)に基づいています。
A total of 96 of 104 spontaneous abortions (92.3%) occurred before 13 weeks of gestation.
‡ 104件中96件の自然流産(92.3%)が妊娠13週前に発生しました。
The denominator includes live-born infants and stillbirths.
§ 分母には生児と死産が含まれます。
The denominator includes only participants vaccinated before 37 weeks of gestation.
¶ 分母には妊娠37週より前にワクチンを接種した参加者のみが含まれます。
Small size for gestational age indicates a birthweight below the 10th percentile for gestational age and infant sex according to INTERGROWTH-21st growth standards (http://intergrowth21.ndog.ox.ac.uk. opens in new tab). These standards draw from an international sample including both low-income and high-income countries but exclude children with coexisting conditions and malnutrition. They can be used as a standard for healthy children growing under optimal conditions.
‖ 在胎不当過小とは、INTERGROWTH-21st Growth Standards(http://intergrowth21.ndog.ox.ac.uk)の基準に従って、在胎週数と乳児の性別から計算される、10パーセンタイル未満の出生体重を示します。これらの基準は、低所得国と高所得国の両方を含む国際的なサンプルから得られたものですが、併存疾患を持つ子供と栄養失調の子供は除外されています。従って、これらの基準は、最適な条件下で成長する健康な子供のための基準として使用可能です。
Values include only major congenital anomalies in accordance with the Metropolitan Atlanta Congenital Defects Program 6-Digit Code Defect List (www.cdc.gov/ncbddd/birthdefects/macdp.html. opens in new tab); all pregnancies with major congenital anomalies were exposed to Covid-19 vaccines only in the third trimester of pregnancy (i.e., well after the period of organogenesis).
値には、Metropolitan Atlanta Congenital Defects Program 6-Digit Code Defect List(www.cdc.gov/ncbddd/birthdefects/macdp.html)に従って、主要な先天性異常のみが含まれます。主要な先天性異常を伴うすべての妊娠は、妊娠第3期(すなわち、器官形成の期間のかなり後)にのみ、新型コロナワクチンに曝露されました。
Neonatal death indicates death within the first 28 days after delivery.
新生児死亡とは、出産後の最初の28日以内の死亡を示します。
Adverse outcomes among 724 live-born infants — including 12 sets of multiple gestation — were preterm birth (60 of 636 among those vaccinated before 37 weeks [9.4%]), small size for gestational age (23 of 724 [3.2%]), and major congenital anomalies (16 of 724 [2.2%]);
724人の生児(12組の多胎妊娠を含む)のうち、有害な転帰は、早産(37週前にワクチン接種したを含む636人のうち60人[9.4%])、在胎不当過小(724人中23人[3.2%])、および主要な先天性異常(724人中16人[2.2%])でした。
no neonatal deaths were reported at the time of interview.
聞き取り調査の時点で新生児死亡は報告されていません。
Among the participants with completed pregnancies who reported congenital anomalies, none had received Covid-19 vaccine in the first trimester or periconception period, and no specific pattern of congenital anomalies was observed.
先天性異常を報告し妊娠を終えた参加者の中で、妊娠第1期または受胎前後の期間に新型コロナワクチンを接種した人はいませんでした。また、先天性異常に特定のパターンは確認されませんでした。
Calculated proportions of pregnancy and neonatal outcomes appeared similar to incidences published in the peer-reviewed literature (Table 4).
妊娠と新生児転帰の割合は、査読済みの文献で発表されている発生率と同様と思われました(表4)。
ADVERSE-EVENT FINDINGS ON THE VAERS
VAERS(有害事象報告システム)における有害事象の所見
During the analysis period, the VAERS received and processed 221 reports involving Covid-19 vaccination among pregnant persons;
分析期間中、VAERSは、妊婦の新型コロナワクチン接種に関する221件の(有害事象の)報告を受け取り処理しました。
155 (70.1%) involved nonpregnancy-specific adverse events, and 66 (29.9%) involved pregnancy- or neonatal-specific adverse events (Table S4).
155(70.1%)は非妊娠特有の有害事象に関するもので、66(29.9%)は妊娠または新生児特有の有害事象に関するものでした(表S4)。
The most frequently reported pregnancy-related adverse events were spontaneous abortion (46 cases; 37 in the first trimester, 2 in the second trimester, and 7 in which the trimester was unknown or not reported), followed by stillbirth, premature rupture of membranes, and vaginal bleeding, with 3 reports for each.
最も多く報告された妊娠関連の有害事象は、自然流産(46例。内訳は、第1期に37例、第2期に2例、時期不明が7例)であり、死産/前期破水/不正出血がそれぞれ3つ報告されました。
No congenital anomalies were reported to the VAERS, a requirement under the EUAs.
先天性異常はVAERSに報告されませんでした。先天性異常が無いことは緊急使用許可(EUA)の要件の1つです。
Discussion
討論
This U.S. surveillance review of the safety of mRNA Covid-19 vaccines during pregnancy and the periconception period indicates that some pregnant persons in the United States are choosing to be vaccinated against Covid-19 in all trimesters of pregnancy.
米国のこの調査報告(妊娠中および受胎前後の期間におけるmRNA新型コロナワクチンの安全性の調査)は、米国で妊娠した人の一部が、妊娠期間(第1期、第2期、第3期)のどこかで新型コロナワクチンの接種をしていることを示しています。
Solicited local and systemic reactions that were reported to the v-safe surveillance system were similar among persons who identified as pregnant and nonpregnant women.
V-safe監視システムに報告された非自発的な(ワクチンの)局所および全身の副反応は、妊娠中および非妊娠中の女性の間で類似していました。
Although not directly comparable, the proportions of adverse pregnancy and neonatal outcomes (e.g., fetal loss, preterm birth, small size for gestational age, congenital anomalies, and neonatal death) among participants with completed pregnancies from the v-safe pregnancy registry appear to be similar to the published incidences in pregnant populations studied before the Covid-19 pandemic.
直接比較することはできませんが、V-safe妊娠レジストリによると、妊娠を終えた参加者の有害な妊娠および新生児転帰(胎児の喪失、早産、在胎不当過小、先天性異常、新生児死亡など)の割合は、新型コロナのパンデミックの前に調査された妊婦における発生率と同様です。
Many participants in the v-safe pregnancy registry were included in the phase 1a (highest) priority group for Covid-19 vaccination owing to their work as health care personnel.
V-safe妊娠レジストリの多くの参加者は、医療従事者として働いていたため、新型コロナワクチン接種のフェーズ1a(最高)優先グループに含まれていました。
V-safe participation is voluntary, and registration information is not uniformly available at all vaccination locations, although information about the surveillance system is included on the EUA fact sheets for health care providers and patients.
V-safeへの登録は任意であり、登録に関する情報はすべての予防接種場所で一律に入手できるわけではありませんが、V-safe監視システムに関する情報は医療提供者と患者向けの緊急使用許可(EUA)ファクトシート(重要事項説明書)に含まれています。
Thus, comparisons of the proportions of vaccinated women with these outcomes to previously published estimates are limited by likely differences between these populations in age, ethnic group, and other social, demographic, and clinical characteristics that are known to be associated with pregnancy and neonatal outcomes.
したがって、ワクチンを接種した女性のこれらの転帰の割合と、以前に発表された推定値との比較は、集団の違い(妊娠と新生児転帰に影響を及ぼす年齢、民族、その他の社会的特徴、人口統計学的特徴、臨床的特徴の違い)によって制限されます。
However, such comparisons are helpful to provide a crude sense of whether there are any unexpected safety signals in these early data.
ただし、これらの比較は、このような初期データに予期せぬ危険が含まれているかどうかについて、大まかな判断を行うのに役立ちます。
At the time of this analysis, just 14.7% of persons who identified as pregnant in the v-safe surveillance system had been contacted to offer enrollment in the pregnancy registry.
この分析の時点では、V-safe監視システムで妊婦と特定された人のうちわずか14.7%が、V-safe妊娠レジストリへの登録を促す連絡を受けとりました。
Other limitations should also be noted.
その他の制限にも注意する必要があります。
As with all participant-reported surveillance systems, mistakes in completion of v-safe health surveys can result in misclassification of participants as pregnant;
他の参加者報告型の監視システムと同様、V-safe健康調査で入力ミスがあると、妊娠していない参加者が間違って妊婦として分類される可能性があります。
as a result, data for local and systemic reactions that participants reported to the v-safe platform may include some reports from nonpregnant persons.
その結果、V-safeプラットフォームに参加者から報告された局所および全身の服反応のデータには、妊娠していない人からの報告が含まれることがあります。
Participants are not required to complete surveys at the same time every day, and our ability to assess onset or duration of adverse events, such as fever, is limited.
参加者は毎日同じ時間に調査を完了する必要はないため、発熱などの有害事象の発症や期間を評価するには限界があります。
The registry data are preliminary, are from a small sample, and describe mostly neonatal outcomes from third-trimester vaccination;
登録データは予備的なものであり、サンプルは少数であり、主に妊娠の第3期にワクチンを接種した場合の新生児の転帰について説明するものです。
the findings may change as additional pregnancy outcomes are reported and the sample size increases, which may facilitate detection of rare outcomes.
より多くの妊娠転帰が報告され、サンプルの数が増えると、調査結果が変わる可能性があり、まれな転帰の発見につながるかもしれません。
We were unable to evaluate adverse outcomes that might occur in association with exposures earlier in pregnancy, such as congenital anomalies, because no pregnant persons who were vaccinated early in pregnancy have had live births captured in the v-safe pregnancy registry to date; follow-up is ongoing.
妊娠初期のワクチン接種によって起きる可能性がある有害な結果(先天性異常など)を評価することはできませんでした。これは、妊娠初期にワクチン接種を受けた妊婦が、現在のところ、V-safe妊娠レジストリに出生を記録していないためです。フォローアップは引き続き行われています。
In addition, the proportion of pregnant persons who reported spontaneous abortion may not reflect true postvaccination proportions because participants might have been vaccinated after the period of greatest risk in the first trimester, and very early pregnancy losses might not be recognized.
さらに、自然流産を報告した妊婦の割合は、ワクチン接種後の実際の割合を反映していない可能性があります。なぜなら、参加者がワクチンを接種したのは、妊娠第1期の最もリスクが高い期間の後だった可能性があり、非常に早い時期の妊娠喪失が認識されていなかった可能性があるからです。
Whereas some pregnancies with vaccination in the first and early second trimester have been completed, the majority are ongoing,
妊娠第1期と第2期の初期に予防接種を受けた一部の妊婦の妊娠が終わった一方で、大部分はまだ妊娠中です。
and a direct comparison of outcomes on the basis of timing of vaccination is needed to define the proportion of spontaneous abortions in this cohort.
この集団(コホート)における自然流産の割合を定義するには、ワクチン接種のタイミングに基づいた結果を直接比較する必要があります。
Because of sample-size constraints, both pregnancy and neonatal outcomes were calculated as a proportion instead of a rate.
サンプル数の制約のため、妊娠と新生児の両方の結果は、rate(特定期間内の頻度)ではなくproportion(特定集団内の割合)として算出されました。
Our preliminary analysis uses participant-reported data and has limited information on other potential risk factors for adverse pregnancy and neonatal outcomes.
私たちの予備分析では、参加者から報告されたデータを使用しているため、その他の有害な妊娠や新生児転帰についての潜在的な危険因子に関する情報は限られています。
The VAERS is subject to the limitations of passive surveillance.
VAERSには受動的調査に特有の制限があります。
Despite EUA mandatory reporting requirements and CDC guidance on VAERS reporting, there is probably substantial underreporting of pregnancy- and neonatal-specific adverse events.
緊急使用許可(EUA)の義務的な報告要請とVAERSへの報告を促すCDCのガイダンスがあるにもかかわらず、おそらく、妊娠および新生児特有の有害事象が、かなり過少に報告されています。
We also do not know the total number of Covid-19 vaccine doses administered to pregnant persons, which further limits our ability to estimate rates of reported adverse events from VAERS data.
また、妊娠中の人に接種された新型コロナワクチンの総数もわかりません。従って、VAERSデータから報告された有害事象の発生率を推定することがさらに難しくなります。
Among pregnancy-specific conditions reported to the VAERS after Covid-19 vaccination, miscarriage was the most common.
新型コロナワクチン接種後に、VAERSに報告された妊娠特有の有害事象のうち最も一般的だったのは、流産でした。
This is similar to what was observed during the influenza A (H1N1) pandemic in 2009 after the introduction of the 2009 H1N1 inactivated influenza vaccine, where miscarriage was the most common adverse event reported by pregnant persons who received that vaccine.
これは、2009年のH1N1不活化インフルエンザワクチンの導入後に、同年に起きたインフルエンザA(H1N1)のパンデミック中に観察された有害事象と似ています。流産は、H1N1不活化インフルエンザワクチンを接種した妊婦によって報告された、最も一般的な有害事象でした。
In addition to vaccination protecting women against Covid-19 and its complications during pregnancy, emerging evidence has shown transplacental transfer of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) antibodies after maternal Covid-19 vaccination during the third trimester,
新型コロナワクチンを接種することにより、新型コロナと新型コロナによる妊娠中の合併症から女性を守ることができますが、さらに、妊娠第3期にワクチンを接種した母親から、胎盤を通じて胎児にも新型コロナウイルス(SARS-CoV-2)への抗体が受け継がれたという新たな証拠が見つかっています。
which suggests that maternal vaccination might provide some level of protection to the neonate.
これはつまり、母親がワクチンを接種することにより、新生児をある程度守る効果があるということを示唆しています。
However, we do not have data on antibody transfer and level of protection relative to the timing of vaccination.
しかし、抗体の移動と防御効果を、ワクチン接種のタイミングと関連付けたデータはありません。
The CDC and the FDA are continuing to monitor and disseminate information about the safety of mRNA and additional types of Covid-19 vaccines in pregnant persons.
CDCとFDAは、妊婦に対するmRNA新型コロナワクチンの安全性に関する情報の監視と周知を続けています。
Early data from the v-safe surveillance system, the v-safe pregnancy registry, and the VAERS do not indicate any obvious safety signals with respect to pregnancy or neonatal outcomes associated with Covid-19 vaccination in the third trimester of pregnancy.
V-safe監視システム/V-safe妊娠レジストリ/VAERSの初期のデータによれば、妊娠第3期に新型コロナワクチンを接種した場合において、妊娠または新生児の転帰に対する明らかな安全性の懸念は示されていません。
Continued monitoring is needed to further assess maternal, pregnancy, neonatal, and childhood outcomes associated with maternal Covid-19 vaccination, including in earlier stages of pregnancy and during the preconception period.
新型コロナワクチンを接種した妊婦について、妊娠初期や受胎前の期間を含めてその母親/妊娠/新生児/小児の転帰をさらに評価するには、継続的なモニタリングが必要です。
Meanwhile, the present data can help inform decision making about vaccination by pregnant persons and their health care providers.
一方、現在のデータは、妊娠中の人とその医療提供者が、ワクチン接種の可否を判断するための情報として役立ちます。
Disclosure forms provided by the authors are available with the full text of this article at NEJM.org.
著者によって提供された開示フォームは、この記事の全文とともに、NEJM.orgで入手できます。
The findings and conclusions in this article are those of the authors and do not necessarily represent the official position of the Centers for Disease Control and Prevention (CDC) or the Food and Drug Administration (FDA).
この記事の調査結果と結論は著者によるものであり、米国疾病予防管理センター(CDC)または食品医薬品局(FDA)の公式の立場を表しているとは限りません。
Mention of a product or company name is for identification purposes only and does not constitute endorsement by the CDC or the FDA.
製品名または会社名の記載は識別のみを目的としており、CDCまたはFDAによる承認を意味するものではありません。
All authors are U.S. government employees or U.S. government contractors and do not have any material conflicts of interest.
著者の全員は米国政府職員または米国政府請負業者であり、重大な利益相反はありません。
Oracle provided in-kind technical support to build and maintain the v-safe after vaccination health checker infrastructure for data capture and messaging to participants.
参加者のデータ収集とメッセージの送信を行うV-safeワクチン接種後ヘルスチェッカーの構築と保守について、Oracleから技術サポートをご提供いただきました。
This article was published on April 21, 2021, at NEJM.org.
この記事は、2021年4月21日にNEJM.orgで公開されました。
A data sharing statement provided by the authors is available with the full text of this article at NEJM.org.
著者から提供されたデータ共有の声明は、この記事の全文と共にNEJM.orgで閲覧できます。
We thank the v-safe participants, the members of the Oracle v-safe development team for their contributions, and the members of the CDC COVID-19 Response Team for their support.
V-safeの参加者、Oracle V-safe開発チームメンバーの貢献、そしてCDCの新型コロナ応答チームのメンバーのサポートに、感謝を申し上げます。
その他の参考記事
mRNAワクチン接種で82%流産のデマ(kj氏)
https://note.com/kj62824378/n/nbc7b45ac1328
ワクチンで妊婦の82%が流産するというデマとソース論文の読解(pogemutaBN氏)
ワクチンで妊婦の82%が流産するというデマとソース論文の読解
「NEJM論文によればワクチン接種を受けた妊婦の流産率が82%」はデマ(伊賀治氏)
「NEJM論文によればワクチン接種を受けた妊婦の流産率が82%」はデマ(伊賀治氏)
Fact Check-Data from a study does not conclude that over 80% of pregnancies end in miscarriage after COVID-19 vaccinations; figures taken out of context(REUTERS)
検索キーワード:82パーセント
 ほえのブログ
ほえのブログ